- 普吉華®是中國首個且唯一獲批用於RET突變甲狀腺髓樣癌及RET融合陽性甲狀腺癌的選擇性RET抑制劑
- 繼2021年3月,中國國家藥品監督管理局批准普吉華®用於既往接受過含鉑化療的RET融合陽性的局部晚期或轉移性非小細胞肺癌後,普吉華®成功拓展適應症
蘇州2022年3月14日 /美通社/ — 基石藥業(香港聯交所代碼:2616),一家專注於研究開發及商業化創新腫瘤免疫療法及精准治療藥物的領先生物制藥公司,今日宣布,選擇性RET抑制劑普吉華®(普拉替尼膠囊)的擴展適應症申請已經獲得中國國家藥品監督管理局(NMPA)批准。該項擴展適應症包括需要系統性治療的晚期或轉移性轉染重排(RET)突變型甲狀腺髓樣癌(MTC)成人和12歲及以上兒童患者的治療,以及需要系統性治療且放射性碘難治(如果放射性碘適用)的晚期或轉移性RET融合陽性甲狀腺癌(TC)成人和12歲及以上兒童患者的治療。
基石藥業董事長兼首席執行官江寧軍博士表示:「我們很高興普吉華®擴展適應症獲批,為中國RET突變甲狀腺髓樣癌及RET融合陽性甲狀腺癌患者帶來新的治療選擇,也特別感謝國家藥品監督管理局的優先審評審批。基石藥業始終致力於研發創新藥物,滿足癌症患者未解決的醫療需求。我們將持續增強管線開發的臨床價值和市場潛力,加速為全球患者帶來更多高品質的新藥。」
普吉華®ARROW研究主要研究者、天津市人民醫院院長高明教授表示:「近年來,甲狀腺癌發病率持續上升。臨床上對MTC治療手段有限,亟待精准靶向尤其是針對RET突變MTC患者的治療方案。普吉華®在晚期或轉移性RET突變MTC中國患者中顯示出了優越和持久的抗腫瘤活性,整體安全性與全球人群相似。隨著普吉華®擴展適應症的獲批,我們期待能夠解決更多甲狀腺癌患者亟待滿足的臨床需求。」
基石藥業首席醫學官楊建新博士表示:「普吉華®擴展適應症的獲批是繼其獲批用於RET基因融合陽性的局部晚期或轉移性非小細胞肺癌之後的又一重要裡程碑。我們感謝所有為普吉華®擴展適應症的臨床開發做出貢獻的患者和研究者們。我們還將繼續推進普吉華®在其他多種腫瘤中的臨床研究,早日將更多的創新療法惠及更多患者。」
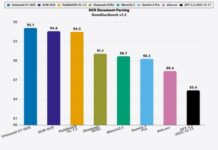
普吉華®拓展適應症的獲批是基於一項全球I/II期ARROW臨床研究,旨在評估普吉華®在RET融合陽性的非小細胞肺癌、RET突變型甲狀腺髓樣癌和其他RET融合的晚期實體瘤患者中的安全性、耐受性和有效性的全球臨床研究。截止2021年4月12日,共有來自中國研究中心的28例RET突變陽性MTC患者納入了全球ARROW研究中國MTC注冊橋接隊列,並接受普吉華®起始劑量為400 mg(每日一次)的治療。研究顯示,26例基線具有可測量病灶的RET突變患者中確認的客觀緩解率(ORR)為73.1%, 包括3例完全緩解和16例部分緩解,疾病控制率(DCR)為84.6%。無論RET突變基因型如何,均有緩解。19例確認緩解的患者中,中位緩解持續時間(DOR)未達到,9個月的DOR率為100%。降鈣素和癌胚抗原(CEA)水平均有大幅降低。普吉華®耐受良好,在中國患者中整體安全可控,且沒有發現新的安全信號。此中國患者的注冊研究結果在2021年第90屆美國甲狀腺協會年度會議(The 90th Annual Meeting of the American Thyroid Association 2021)上,以重磅口頭報告(Late Breaking Oral)形式公布詳細數據。
關於甲狀腺癌
甲狀腺癌是最常見的內分泌惡性腫瘤,近幾年發病率顯著上升。根據世界衛生組織國際癌症研究機構(IARC)發布的2020年全球最新癌症負擔數據,中國在2020年約有22萬新發甲狀腺癌病例數,其中女性新發病例數約為17萬[1]。甲狀腺癌發病率位居我國城市地區女性所有惡性腫瘤的第4位。
甲狀腺癌在臨床上分為乳頭狀癌、濾泡癌、未分化癌和髓樣癌等多個亞型,不同類型的甲狀腺癌根據其腫瘤特點,治療手段及預後均不相同。
RET融合和激活突變是許多癌症類型(包括NSCLC和多種類型的甲狀腺癌)中的關鍵疾病驅動因素。大約10-20%的甲狀腺乳頭狀癌(最常見的甲狀腺癌)患者攜帶RET融合,大約90%的晚期甲狀腺髓樣癌(約占甲狀腺癌的2-5%)患者攜帶RET突變。
關於普吉華®(普拉替尼膠囊)
普吉華®是一種口服、每日一次、強效高選擇性RET抑制劑,已獲中國國家藥品監督管理局批准,用於治療既往接受過含鉑化療的轉染重排(RET)基因融合陽性的局部晚期或轉移性非小細胞肺癌(NSCLC)成人患者,需要系統性治療的晚期或轉移性RET突變型甲狀腺髓樣癌(MTC)成人和12歲及以上兒童患者,以及需要系統性治療且放射性碘難治(如果放射性碘適用)的晚期或轉移性RET融合陽性甲狀腺癌(TC)成人和12歲及以上兒童患者。
美國食品藥品監督管理局批准其以商品名為GAVRETO上市銷售,三項適應症分別為:用於治療經FDA批准的檢測方法檢測證實為轉移性RET融合陽性NSCLC的成人患者、需要系統性治療的晚期或轉移性RET突變甲狀腺髓樣癌成人和12歲及以上兒童患者,以及需要系統性治療且放射性碘難治(如適用)的晚期或轉移性RET融合陽性甲狀腺癌成人和12歲及以上兒童患者。這些適應症基於ORR和DOR數據在加速審批途徑下獲得批准。針對這些適應症的持續批准可能取決於確證性試驗中臨床獲益的驗證和描述。
歐盟委員會(EC)已授予GAVRETO有條件上市許可,作為一種單一療法,用於治療未接受過RET抑制劑治療的RET融合陽性晚期NSCLC成人患者。
普吉華®在中國、美國、歐洲還未獲批用於其他適應症。
普吉華®旨在選擇性地和有效地靶向致癌性RET突變,包括可能導致治療耐藥的繼發性RET突變。在臨床前研究中,普吉華®抑制RET的濃度低於其他藥物相關激酶,包括VEGFR2、FGFR2和JAK2。
普吉華®由基石藥業合作伙伴Blueprint Medicines公司開發。基石藥業與Blueprint Medicines公司達成了獨家合作和許可協議,獲得普吉華®在大中華地區的獨家開發和商業化權利。
Blueprint Medicines和羅氏正在全球(不包括大中華地區)共同開發GAVRETO,用於治療RET突變的NSCLC、甲狀腺癌和其他實體瘤患者。Blueprint Medicines和羅氏集團成員公司基因泰克正在美國共同商業化GAVRETO,羅氏擁有GAVRETO在美國以外(不包括大中華地區)的獨家商業化權利。FDA授予GAVRETO突破性療法認定,用於治療鉑類化療後進展的RET融合陽性NSCLC,以及需要全身治療且尚無替代療法的RET突變陽性甲狀腺髓樣癌。
關於基石藥業
基石藥業(香港聯交所代碼: 2616)是一家生物制藥公司,專注於研究開發及商業化創新腫瘤免疫治療及精准治療藥物,以滿足中國和全球癌症患者的殷切醫療需求。成立於2015年底,基石藥業已集結了一支在新藥研發、臨床研究以及商業運營方面擁有豐富經驗的世界級管理團隊。公司以腫瘤免疫治療聯合療法為核心,建立了一條15種腫瘤候選藥物組成的豐富產品管線。目前,基石藥業已經獲得了4款創新藥的7項新藥上市申請的批准。多款後期候選藥物正處於關鍵性臨床試驗或注冊階段。基石藥業的願景是成為享譽全球的生物制藥公司,引領攻克癌症之路。
欲了解更多,請瀏覽www.cstonepharma.com。
前瞻性聲明
本文所作出的前瞻性陳述僅與本文作出該陳述當日的事件或資料有關。除法律規定外,於作出前瞻性陳述當日之後,無論是否出現新資料、未來事件或其他情況,我們並無責任更新或公開修改任何前瞻性陳述及預料之外的事件。請細閱本文,並理解我們的實際未來業績或表現可能與預期有重大差異。本文內所有陳述乃本文章刊發日期作出,可能因未來發展而出現變動。
聲明:僅供醫療衛生專業人士交流使用。