安全數據有助建立 B 部分劑量擴展和第 2 期劑量;數據顯示,先前 PD1/PDL1 治療失敗的非小細胞肺癌患者顯示令人鼓舞的抗腫瘤活性(8 名可評估患者中有 4 名顯示部分反應)
紐約水牛城, Sept. 16, 2021 (GLOBE NEWSWIRE) — Athenex, Inc., (NASDAQ: ATNX) 作為一家全球生物製藥公司,致力發現與開發治療癌症和相關疾病的新型療法並將其商業化,今天宣佈將公佈來自第一期研究的數據,以評估口服紫杉醇和 encequidar(口服紫杉醇)與 pembrolizumab 併合治療晚期實體瘤患者的安全性、耐受性和活性。將在 2021 年 9 月 16 日至 9 月 21 日舉行的 2021 歐洲腫瘤醫學協會 (ESMO) 虛擬會議以摘要海報發表有關數據。
Athenex 醫療總監 Rudolf Kwan 博士說:「令人鼓舞的中期第一期數據表示,在接受 PD1/PDL1 治療後病情惡化的肺癌患者中觀察到口服紫杉醇併合 pembrolizumab 具備前景明朗的抗癌活性,以及預期的安全性和耐受性。PD1/PDL1 療法是肺癌的重要治療方法,但大多數患者最終病情惡化,而這些患者代表尚未滿足的高度醫療需求。我們現正努力在本研究的劑量擴展階段中確認這些數據。」
設有擴展小組的第一期研究評估 Oraxol(口服紫杉醇 + Encequidar)與 Pembrolizumab 併合治療晚期實體惡性腫瘤患者的安全性、耐受性和活性
研究劑量劑量遞增階段的主要目標是確定最大耐受劑量 (MTD),並確定口服紫杉醇併合 pembrolizumab 治療晚期實體腫瘤患者的建議第二期劑量 (RP2D)。
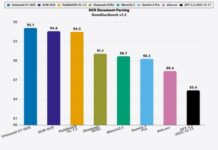
該研究的劑量遞增階段已納入 21 名患者。發表提供 17 名可評估反應患者的活動數據,其中包括 8 名非小細胞肺癌患者,以及頭頸癌、葡萄膜黑色素瘤、食道癌、腸癌和膀胱癌患者。四名患者顯示部分反應,10 名患者顯示病情穩定,三名患者顯示病情惡化。治療持續時間從 9 天至 676 天以上不等。
共有 10 名非小細胞肺癌患者參加,其中 8 名可評估反應。四名患者顯示部分反應,另有四名患者顯示病情穩定。所有人都因病情惡化而停止了先前的檢查點抑制劑療法。
研究未能找到併合治療的最大耐受劑量。RP2D 與 pembrolizumab 併合使用獲選為口服紫杉醇 270 毫克,在第 1 天至第 3 天每日一次,為期 2 週,當中每個週期為期 3 週。研究將在擴展小組繼續,並將納入更多非小細胞肺癌患者,以進一步評估口服紫杉醇與 pembrolizumab 的安全性和臨床活性。
關於口服紫杉醇和 Encequidar 與 Pembrolizumab 併合的第一期研究
第一期研究是一項開放標籤劑量遞增設計研究,隨後是雙組擴展小組。劑量遞增使用「3+3」設計,而符合條件的患者具有轉移性或不可切除的實體腫瘤,當中 pembrolizumab 是獲得 FDA 批准的療法。經研究的口服紫杉醇劑量範圍為 270-330 毫克,每週最多可使用 2 天,最長為 5 天,為期 3 週。Pembrolizumab 200 毫克經靜脈輸注,每三週用藥一次。研究 A 部分的主要目標是確定最大耐受劑量,並確定口服紫杉醇併合 pembrolizumab 治療晚期實體腫瘤患者的建議第二期劑量。次要目標包括紫杉醇的安全性和耐受性、紫杉醇的藥物動力學,以及初步抗腫瘤活性。最大耐受劑量和劑量限制性毒性是根據第一個為期 3 週治療週期內所觀察到的毒性來確定。治療反應由每 9 週經 RECIST 1.1 評估的電腦斷層掃描確定。 B 部分劑量擴展階段將納入非小細胞肺癌受試者,以進一步評估研究治療的活性、安全性和耐受性。
有關該研究的更多資訊,請瀏覽 ClinicalTrials.gov,識別碼:NCT03588039。
關於 Athenex, Inc.
Athenex, Inc. 創立於 2003 年,是一家臨床階段的國際生物製藥公司,並致力成為研究與開發下一代癌症治療藥物及將其商業化的領導者。Athenex 設有三個平台,分別為腫瘤創新平台、商業平台及全球供應鏈平台。公司現有的臨床產品系列源自四個不同平台的科技:(1) 以 p-糖蛋白抑制劑為基礎的 Orascovery;(2) Src 酶抑制劑;(3) 細胞療法及 (4) 精氨酸消除療法。Athenex 的員工遍佈全球,致力透過開發更有效及耐受的治療以改善癌症病人的生活。如欲了解更多資訊,請瀏覽 www.athenex.com。
前瞻性陳述
除了歷史上的資訊,所有在新聞稿中的聲明、期望及假設均為前瞻性陳述。這些前瞻性陳述通常通過諸如「預料」、「相信」、「繼續」、「將能」、「估計」、「預期」、「預見」、「目標」、「指導」、「打算」、「可能」、「應會」、「計劃」、「潛在」、「預計」、「初步」、「或許」、「策劃」、「承諾」、「尋求」、「應該」、「將願」、「將會」及類似的用詞作表達。實際結果可能與前瞻性陳述中明確或隱含的結果不同。可能導致實際結果出現重大差異的重要因素包括:我們的主要臨床候選藥物的開發階段以及涉及藥物開發、臨床試驗、監管的相關風險,監管審查和批准的不確定性;我們與 FDA 就一項具有資本和時間效率的新口服紫杉醇臨床研究達成一致的能力;我們為目前和未來獲得批准的產品擴展製造和商業供應的業務能力,以及一旦獲得批准就能夠將我們的產品商業化;能夠成功證明其候選藥物的安全性和有效性,並及時獲得其候選藥物的批准(如果有的話)的能力;Athenex 候選藥物的臨床前和臨床結果,可能不支援此類候選藥物的進一步開發;與我們將 Kuur 的業務成功整合到我們現有業務中的能力相關的風險,包括與維持與客戶、供應商和員工的關係相關的不確定性,以及可能延遲成功整合和我們在營運、文化和管理理念的差異支援 Kuur 業務的額外成本負擔的能力;與交易對手表現相關的風險,包括我們依賴第三方在 Athenex 業務的某些領域取得成功;我們的經營虧損歷史以及我們籌集額外資金的需求和能力;我們能否滿足融資協議項下的融資條件以及獲得資金的能力存在不確定性;訴訟中固有的風險和不確定性,包括所謂的股東集體訴訟;與 2019 冠狀病毒病疫情相關的風險和不確定性及其對我們的營運、供應鏈、現金流和財務狀況的持續影響;競爭;知識產權風險;我們能否及時、以經濟高效方法成功整合收購和合併的業務以及實現協同效應的能力存在不確定性;與在國際和中國開展業務相關的風險;我們的製造設施的開發、營運延遲、生產放緩或停工或其他中斷的風險,以及我們尋找替代供應來源以滿足我們的義務和要求的能力;以及我們在美國證券交易委員會 (SEC) 文件中不時列出的其他風險因素,其副本可在我們網站的投資者關係部分免費獲得,網址為 http://ir.athenex.com/phoenix.zhtml?c=254495&p=irol-sec,或向我們投資者關係部門要求索取。本新聞稿中提供的所有資訊均截至本新聞稿發佈之日,除了法律要求,否則我們不承擔任何義務,亦不打算更新這些前瞻性陳述。
Athenex 聯絡人
投資者
Daniel Lang 醫學博士
Athenex, Inc. |
電郵:[email protected]
Caileigh Dougherty
Athenex, Inc. |
電郵:[email protected]